グリシンは神経活動を抑制し、痛みの信号、運動制御、感覚処理を調整する主要な抑制性神経伝達物質です。グリシントランスポーター2(GlyT2)は、シナプス間隙からグリシンを除去することでグリシン作動性神経伝達を調節する重要な役割を果たしています。GlyT2が抑制されると、グリシンの再取り込みが減少し、シナプス内のグリシン濃度が上昇し、抑制信号が強化されます。神経障害性疼痛の治療において、GlyT2はグリシン作動性伝達を調節する能力から魅力的な治療ターゲットとなっています。特に、非オピオイドの痛み管理の新たな手段を示唆するため、注目されています。
新たな構造的洞察
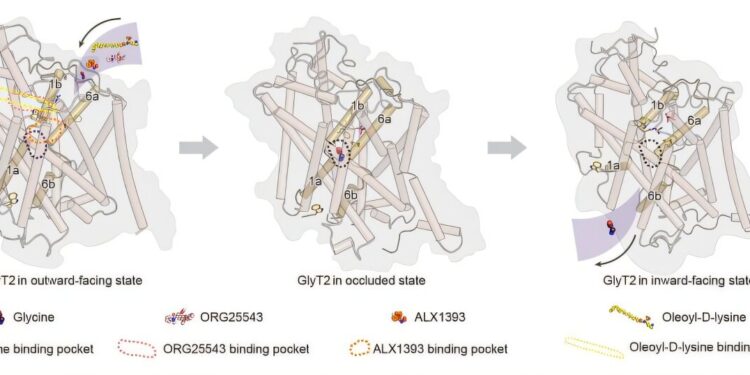
11月25日に『アメリカ国立科学アカデミー紀要』に発表された新しい研究では、中国科学院生物物理研究所の趙燕教授率いる研究チームが、GlyT2の3つの主要な構造状態における高解像度のクライオ電子顕微鏡(cryo-EM)構造を報告しました。これらの構造は、トランスポーターの分子メカニズムを明らかにし、鎮痛化合物がどのように認識されるかについての重要な洞察を提供します。研究者たちは、GlyT2に新たに発見された第三のナトリウム結合部位(Na3)を特定しました。他の神経伝達物質トランスポーターが2つのNa⁺イオンと1つのCl⁻イオンを使用するのに対し、GlyT2は1サイクルあたり3つのNa⁺イオンと1つのCl⁻イオンを使用してグリシンを輸送することを示しています。この追加のナトリウムイオンは、グリシン輸送に必要な追加のエネルギー駆動を供給し、Na⁺/Cl⁻結合基質の結合および構造変化に関する新たな理解を提供し、GlyT2の特化した生理機能を支持します。
痛み治療と薬剤設計への影響
研究者たちはまた、内因性脂質N-アラキドニルグリシンの誘導体であるオレオイル-D-リジンなどの脂質ベースの阻害剤を収容する独特のアロステリック結合ポケットを発見しました。構造的および生化学的分析により、このクラスの脂質分子の抑制力を決定する特徴が明らかになり、改良された脂質ベースのGlyT2鎮痛剤の合理的設計の基盤を提供します。さらに、研究者たちは、ALX1393、オピランセリン、ORG25543などのいくつかの小分子阻害剤に結合したGlyT2の構造を解明しました。これらの構造は、競合的およびアロステリックな抑制メカニズムを明らかにし、GlyT1とGlyT2の選択性に関与する重要な残基を特定します。これらの研究成果は、グリシン輸送と阻害剤認識の包括的な構造フレームワークを提供します。Na3部位を発見し、脂質アロステリックポケットを特定し、多様な抑制メカニズムを解明することで、研究者たちは慢性疼痛に対するより安全で効果的な非オピオイド治療の開発に向けた新たな道を開きました。詳細情報: Yuhang Wang et al.