大腸癌(CRC)は、腫瘍学における依然として大きな課題であり、世界中で最も一般的かつ致命的な悪性腫瘍の一つを占めています。治療の進歩にもかかわらず、末期のCRCと診断された患者は厳しい予後に直面しており、ステージIVの病気では5年生存率がわずか14%にまで低下します。この攻撃的な病態生理の中心には、腫瘍微小環境(TME)があり、ここでは癌関連線維芽細胞(CAFs)が腫瘍の進行、転移、治療抵抗性において主要な影響を及ぼす存在として浮かび上がっています。新たな研究がCAFsが腫瘍マトリックスを調節する分子の複雑さを解明し始めており、特にCRCにおけるコラーゲンの過剰生産を促進する代謝再プログラミングが強調されています。
細胞外マトリックス(ECM)はTMEの重要な構成要素であり、コラーゲンはこの足場の約90%を占めています。過剰なコラーゲンの沈着は、腫瘍を機械的に強化するだけでなく、免疫監視や薬物介入に対する強力な物理的バリアを形成します。コラーゲンの構造的完全性の中心には、三重らせん構造内で最も豊富なアミノ酸であるグリシンがあり、腫瘍環境における十分なグリシン供給を確保するメカニズムはこれまで不明でした。最近の科学的調査により、CRC関連線維芽細胞における重要な代謝シフトが明らかになり、新たに合成されたグリシンがコラーゲンの生産を促進し、ECMを積極的に再構築して癌の進行を助長していることが示されました。
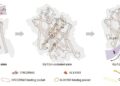
この現象を解明するために、研究者たちは人間の大腸腫瘍および隣接する正常組織から一次線維芽細胞集団を分離し、CAFsと正常線維芽細胞(NFs)の培養を確立して比較分析を行いました。これらの細胞の代謝プロファイリングは、CAFs特有のアミノ酸代謝における顕著な再プログラミングを明らかにしました。特に、活性化された線維芽細胞内のグリシン濃度は、正常な対照群と比較してほぼ倍増しており、CAFs培養から得られた条件付き培地におけるグリシンレベルの上昇によって裏付けられました。興味深いことに、このグリシンの増加は主に内因性合成の増加に起因しており、この経路を制御する酵素機構に注目が集まっています。
さらなる分子特性評価により、グリシン生合成経路の酵素—ホスホグリセリン酸脱水素酵素(PHGDH)、ホスホセリンアミノトランスフェラーゼ1(PSAT1)、ホスホセリンホスファターゼ(PSPH)、およびセリンヒドロキシメチルトランスフェラーゼ2(SHMT2)が、CAFsにおいて転写およびタンパク質レベルで上方制御されていることが明らかになりました。これらの発見は、セリン-グリシン経路の協調的な強化を反映しており、コラーゲン組立の生合成要求を満たすための持続的なグリシン生産を可能にしています。PHGDHはこの経路の律速段階を触媒し、代謝再プログラミングと構造的ECM再構築を結びつける特に重要な酵素として浮かび上がっています。